医療機関の皆様へ
施設側の治験参加メリット
- 治験を通じて院内体制を活性化できます治験に関わる各病院のスタッフの方には、通常よりも綿密な連携を取ることになります。治験をキーとして院内協調体制がこれまでより強化・活性化された多くの事例がございます。
- 保険外収入が経営に寄与します治験研究費が保険収入以外に製薬企業から支払われます。プログレスCRCが支援いたしますので、人員を増やす必要はありません。
- 最先端の医療に取り組んでいることを内外にアピールできます治験に取り組んでいることは、医療の最先端の治験が実施できる十分な設備と機能を有し、経験豊かな優秀な医師とスタッフを擁している医療機関ということが言えます。
- 治験を通して社会貢献ができますより良い新薬が早く承認され、医療上の選択肢を増やすことにより社会に貢献ができます。
患者様の治験参加のメリットとデメリット
患者様のメリット
- 通院1回につき目安として10,000円の協力費が受け取れます。
(患者様の通院に伴う交通費や食費として、製薬企業が概算で目安として10,000円支払う制度です) - 治験投与期間中の臨床検査費や画像診断が無料になります。
(製薬企業が治験薬投与期間中全額負担する制度です) - 副作用があったとき、製薬企業から補償が受けられます。
(裁判を起こすことなく申告により製薬企業の判断で迅速に治療などの補償が受けられます) - 承認される前の最新の医療を受けることができます。
- 治験に参加することにより、医師や看護師にいつでも相談できる万全の体制による治験が受けられます。
患者様のデメリット
- 確立されていない治験法による副作用のリスクがあります。
治験実施体制と委託業務
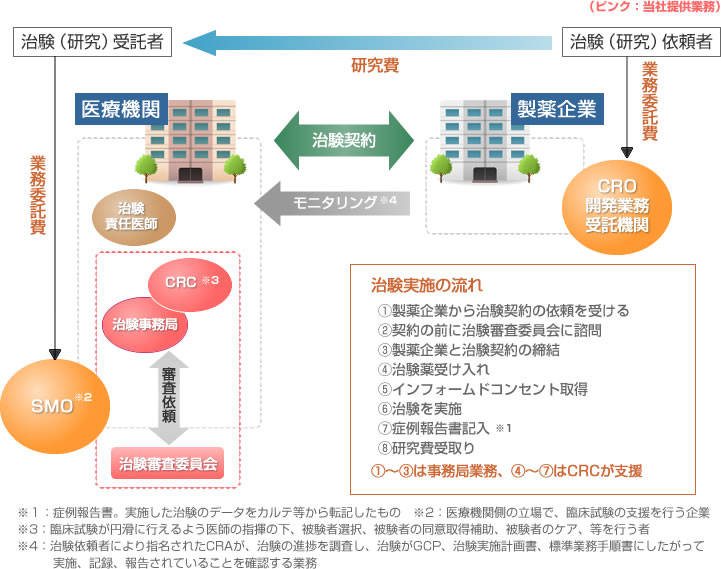
顧客満足を第一に考えた治験業務支援
 治験コーディネーターによるインフォームドコンセント、ケースカード記入補助
治験コーディネーターによるインフォームドコンセント、ケースカード記入補助 治験事務業務支援(治験契約書作成、治験審査委員会等)
治験事務業務支援(治験契約書作成、治験審査委員会等) 被験者に支払う治験協力費の立替
被験者に支払う治験協力費の立替 検査費の製薬企業請求書及びレセプト作成支援
検査費の製薬企業請求書及びレセプト作成支援 治験費用(研究費)の製薬企業へ請求
治験費用(研究費)の製薬企業へ請求 治験コーディネーターの守備範囲を限定しない医療現場への貢献
治験コーディネーターの守備範囲を限定しない医療現場への貢献
治験実施の手順と分担(1)
製薬企業と契約手続(治験審査委員会(IRB)審査も含む)
| プロセス | 先生・事務長様の担当部分 | プログレス社の支援 |
|---|---|---|
| 治験の試験契約 | ご確認ください | 契約書関連の書類のご提供 |
 |
||
| 治験実施に必要な書類 (治験の標準業務手順書 (SOP)等)の準備 |
ご確認ください | 治験実施の書式類のご提供 |
 |
||
| 臨床試験の打診・製薬企業の 依頼前調査対応 |
ご検討ください | 治験実施計画書(プロトコール) 研究費等諸条件のご紹介 |
 |
||
| 製薬企業の訪問対応(依頼調査) | 治験責任者が面接 (受託に前向きな回答を お願いします) |
調査に立ち会います |
 |
||
| 打合せ(製薬企業と契約~ 治験実施手順~終了について) 治験実施がメリットになるような ご提案をいたします |
ご提案 | |
| ご確認ください |
治験実施の手順と分担(2)
製薬企業と契約手続(治験審査委員会(IRB)審査も含む)
| プロセス | 先生・事務長様の担当部分 | プログレス社の支援 |
|---|---|---|
| 業務スケジュール 治験実施手順に則った検査のオーダーの方法 治験のレセプト処理方法 同意取得の方法と役割分担 検査スケジュール 研究費の処理など |
ご確認ください | ご提案いたします (製薬企業との交渉もいたします) |
| 書式類の提供とご説明 提示すべき書類を先生に配布 |
||
 |
||
| 製薬企業へ依頼契約手続き書類を提示 | 必要箇所に御捺印 | (CRCが支援) |
 |
||
| 製薬企業から治験依頼書類受取 | 外部IRBに審査依頼指示※ | 外部IRB審査を仲介(CRCが支援) IRB審査承認 |
 |
||
| 製薬企業と治験契約 | ご確認ください | (CRCが支援) |
※院内で構築することも可能
治験実施の手順と分担(3)
治験実施
| プロセス | 先生・事務長様の担当部分 | プログレス社の支援 |
|---|---|---|
| 治験薬受取 | 受取 | 保管と出納管理(CRCが支援) |
 |
||
| スクリーニング 同意取得 |
同意説明予定の患者様選定 患者様へ御説明(目安として5分程度)
|
(CRCが支援) 詳細説明目安として50分(CRCが実施)
|
 |
同意の確認 (先生と患者様のサイン) |
|
| 治験開始(症例登録) | 製薬企業へ研究費の請求 検査等予約、スケジュール管理、 臨床検査準備、検体の処理、 有害事象対応、患者様への指示 |
|
 |
||
| 治験実施 | 診断(問診、検査指示、処方、カルテ記録) 患者への指示 |
|
 |
医事処理、患者様への協力費*支給、レセプトの製薬企業へ請求**(CRCが支援) |
*:治験来院1回に対し治験依頼者(製薬企業)が目安として10,000円支給する制度
**:投与期間中、臨床検査、画像診断は治験依頼者(製薬企業)負担となっている制度
治験実施の手順と分担(4)
治験終了
| プロセス | 先生・事務長様の担当部分 | プログレス社の支援 |
|---|---|---|
| 症例報告書記入 | コメント、評価部分の御記入、表紙にご捺印 | カルテに記載してあるものは転記 (CRCが実施) |
 |
||
| 製薬企業直接閲覧*とデータ問合せ | ご対応(医学問合せのみ) | 対応可能事項は答弁(CRC) |
 |
||
| 製薬企業側、発生書類の確認 終了報告 |
ご対応(内容確認後、ご捺印) | 事前に書類整理(CRCが実施) 終了報告書作成。 |
 |
||
| 研究費受取 | 現金または口座振込みで受取 |
*:厚生労働省令により、治験依頼者(製薬企業)には、症例報告書のデータが原資料と同一であることを閲覧により検証することが求められ、医療機関側にはプロトコール、契約書、同意説明文書に記載することを前提に供することが義務付けられている








